
di Luca LAPINI
luca.lapini@comune.udine.it
Museo Friulano di Storia Naturale
Via Sabbadini 32, I-33100 UDINE
Lo sciacallo dorato (Canis aureus) è un canide eurasiatico di 12-15 chilogrammi di peso (fig. 1). Molto variabile, raggiunge le massime dimensioni nel meridione europeo con la forma C. a. moreoticus I. Geoffroy Saint Hilaire, 1835, descritta in Grecia ma ormai diffusa in tutta Europa. A meridione Canis aureus raggiunge Israele ma in Africa viene vicariato dal lupo dorato africano (Canis anthus), un piccolo lupo ampiamente diffuso almeno fino al Sudan, col quale è stato a lungo confuso. Canis aureus è incluso nelle liste della Direttiva Habitat 92/43 (All. V), nell’App. III della CITES e in Italia è particolarmente protetto dalla LN 157/92 (si veda anche www.goldenjackal.eu).

La specie è giunta in Italia nel 1984 in seguito ad una graduale espansione verso Nord consentita dalla decimazione del lupo balcanico, culminata nella seconda meta del XX secolo. In condizioni naturali, infatti, il lupo funge da naturale antagonista della specie, predandola attivamente e limitandone la presenza nelle zone coperte da estese formazioni forestali. La riduzione dei contingenti popolazionali del lupo in larga parte dell’Europa sembra essere la causa della impressionante espansione della specie in tutto il subcontinente europeo, dove ha ormai raggiunto il Mare del Nord, l’Ukraina, la Danimarca, la Francia, ecc.
Il recente ritorno del lupo nel Triveneto sta creando scenari biologici inediti anche nel nostro paese, e l’esclusione competitiva tra lupo e sciacallo sembra essere già iniziata in alcune zone del Friuli Venezia Giulia e dell’Alto Adige (Lapini et al., 2018; Auckenthaler, 2019). In caso di coabitazione con il lupo lo sciacallo dorato viene generalmente escluso dalle zone forestali più integre. In queste situazioni la specie tende a colonizzare zone umide alveali, perialveali e lagunari, garighe, macchie mediterranee, aree coltivate, frutteti ed agroecosistemi gestiti in maniera tradizionale.
Le proiezioni più attendibili indicano che l’assestamento della situazione potrà richiedere diverse decine di anni e comunque spingerà lo sciacallo nelle zone più antropizzate, nei delta fluviali o in altre zone umide di pianura (Lapini et al., 2018).
L’espansione dello sciacallo dorato in Italia sembra comunque aver attraversato tre fasi differenti.
–Prima fase (1984-1996): caratterizzata da discreto dinamismo, ha portato ad una prima segnalazione nel Veneto Prealpino, ad alcuni eventi di riproduzione nelle Province di Udine e Belluno e alla colonizzazione del Carso Isontino (Lapini et al., 2018).
–Seconda fase (1997-2008): caratterizzata da una evidente stasi dell’espansione e da una forte riduzione delle presenze complessive, ha comunque portato ad una prima riproduzione nel Muggesano (Istria settentrionale, Provincia di Trieste) e nelle valli del Natisone (Prealpi Giulie, Provincia di Udine), con presenze sempre più diffuse sul Carso Isontino (Provincia di Gorizia) (Lapini et al., 2018).
-Terza fase (2009-2018): periodo di fortissima espansione, distinto da un ulteriore successo riproduttivo nel Veneto alpino (Provincia di Belluno), da vari episodi riproduttivi in Carnia (Prealpi Carniche, Provincia di Udine) e in Alto Adige (Provincia di Bolzano), nelle Valli del Natisone (Prealpi Giulie, Provincia di Udine), sul Carso Isontino (Provincia di Gorizia) e nelle aree steppico magredili dell’alta pianura pordenonese (Provincia di Pordenone) (Lapini et al., 2018).
Il primo gruppo riproduttivo di queste zone, localizzato nell’inverno 2015, è stato raggiunto dai lupi ai primi di ottobre 2016 ed è stato da questi decimato nel quadro di un fenomeno di intra-guild competition culminato con l’uccisione di una femmina dell’anno.
Nel 2017 si sono verificati diversi episodi riproduttivi anche sul Carso sloveno a ridosso del confine con la Provincia di Trieste, con la formazione di alcuni gruppi transfrontalieri. Questi ultimi, pur esercitando gran parte dell’attività nella finitima Repubblica di Slovenia, frequentano anche parte della Provincia di Trieste (zona di Medeazza, Malchina, Monte Lanaro-Fernetti, Alta Val Rosandra). Il grande dinamismo del 2017, forse stimolato proprio dall’incontro coi lupi, ha portato ad una grande dispersione di animali, con presenze isolate in Lombardia (Val Brembana, Provincia di Bergamo) e in Emilia Romagna (Provincia di Modena), a Sud del Po. In val Brembana (Provincia di Bergamo) un esemplare isolato è stato fototrappolato diverse volte tra la località di quota di Carisole (giugno 2017), la periferia del sottostante paese di Valleve e la località di Isola di Fondra (foto S. Locatelli 2017-2019).
Nel 2018 è stato possibile localizzare un nuovo gruppo riproduttivo anche nell’alta pianura udinese, a circa 5 km dal luogo dove nel 1985 si è verificata la prima riproduzione italiana. Ciò indica che la pianura friulana -a 33 anni di distanza- ha conservato una buona vocazionalità per la specie (Lapini et al., 2018). Nel corso del 2019 è stato inoltre possibile individuare sette nuovi gruppi riproduttivi in Friuli Venezia Giulia (fig. 2), e un esemplare apparentemente isolato si è spinto fino ai 2400-2600 metri di quota sui monti della Provincia di Sondrio. Si tratta del massimo limite altitudinale raggiunto dalla specie in Europa e testimonia la sua grande plasticità ecologica, cosa che gli permette di colonizzare gli ambienti più diversi (fig. 2)

A questo punto dell’espansione della specie è possibile stimare che nel nostro paese siano attualmente presenti 50-85 esemplari di Canis aureus, suddivisi in almeno 10-17 gruppi riproduttivi, ancora apparentemente distribuiti soltanto nel Triveneto. I problemi di conservazione della specie sono peraltro notevoli, non solo per il ridotto numero complessivo di animali. In Italia
questi problemi sono legati soprattutto alla elevata mortalità stradale degli sciacalli dorati (in verità soprattutto esemplari giovani), agli abbattimenti illegali, alla dispersione di esche avvelenate (Bregoli et al., 2018). Fra 2017 e 2019 sono morti investiti una trentina di animali, ogni anno il 10% circa dell’intera popolazione italiana (9 esemplari nel solo 2019). Visti gli ingiustificati conflitti sociali che la specie provoca sul Carso Isontino (Provincia di Gorizia) sembra comunque urgente avviare una estesa campagna di public awareness nelle zone di neo-colonizzazione, visto che una corretta comunicazione sui predatori ne condiziona prepotentemente la conservazione. I conflitti fra popolazione rurale e venatoria e sciacallo dorato sono infatti sempre più evidenti, pur in totale assenza di danni (Lapini et al., 2018). Le leggende sulla pericolosità della specie, del resto, non hanno bisogno di dati, hanno portato ad una sua pessima percezione locale e alla dispersione di esche avvelenate sul Carso goriziano (Bregoli et al., 2018), nella convinzione che lo sciacallo dorato sia un grave pericolo per la biodiversità.
La categoria di utenti della natura più preoccupati da queste leggende è certamente quella dei cacciatori, forse gli unici davvero interessati alle sorti della cosiddetta fauna selvatica.
Così, tra il 24 e il 26 ottobre 2019 si è tenuto a Trieste il 67° Convegno AGJSO “Lo sciacallo dorato, cambiamento della biodiversità e la caccia”.
Già l’ingenuo titolo del convegno venatorio ne indicava e indirizzava i contenuti, ma in realtà si è trattato di un convegno piuttosto stimolante, che ha messo a confronto realtà limitrofe (Italia, Austria, Slovenia) e diverse visioni della conservazione biologica. In Italia lo sciacallo dorato è particolarmente protetto (LN 157/92), mentre in Austria e Slovenia gode di un regime di protezione parziale, con varie possibilità di controllo e prelievo, che da maggio 2019 consentiranno la caccia alla specie in Slovenia secondo precisi piani di prelievo.
Con tutta evidenza la biodiversità c’entra poco.
La maggiore preoccupazione del mondo venatorio del Carso italiano -vera ragione del convegno- è stato il crollo dei prelievi di capriolo, particolarmente evidente soprattutto a partire da 2009 e 2011, negli scambi fra cacciatori univocamente addebitato allo sciacallo dorato senza supporto di alcun dato.
L’impressione degli specialisti invitati al convegno in prevalenza indica che i cacciatori venuti all’incontro fossero poco interessati a dati reali, piuttosto indispettiti dal fatto che le informazioni esistenti non confermassero l’assunto di base sotteso dal titolo, indicando altre spiegazioni per il crollo di densità del capriolo sul Carso italiano.
L’esame complessivo dei dati di prelievo venatorio sul Carso italiano fra 1976 e 2018 mostra infatti in maniera evidente che il crollo dei prelievi di capriolo a partire dal periodo compreso fra 2009 e 2011 sul Carso italiano coincide con l’intersezione fra la curva di crescita dei prelievi di cinghiale e la curva di decrescita dei prelievi di capriolo. Crescita dell’uno e decrescita dell’altro sono peraltro singolarmente complementari nel tempo, realizzando un grafico orizzontalmente così simmetrico da far pensare ad una correlazione inversa fra i due trend (fig. 3).
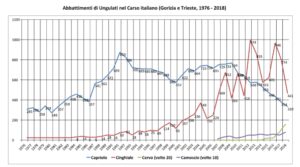
Questi dati, presentati al congresso in maniera molto più dettagliata dal noto specialista di ungulati Franco Perco, sembrano indicare un fenomeno di interazione negativa fra le due specie, ma da soli non spiegano nulla. Così Franco Perco ha anche cercato di capire se le classi di prelievo venatorio giovanili del capriolo fossero particolarmente calate in qualche preciso periodo di caccia compreso fra 1976 e 2018. Ciò avrebbe potuto evidenziare un’eventuale aumentata predazione sui cuccioli da parte dello sciacallo (presente sul Carso goriziano dai primi anni ’90 del XX secolo) o da parte del cinghiale. Una prima analisi visiva dei dati in tre diverse zone carsiche sembra indicare che la diminuzione del prelievo venatorio di classi giovanili di capriolo ci sia stata, ma senza una precisa evidenza temporale, seguendo piuttosto il calo progressivo della specie nel tempo. Questo sembrerebbe indicare fattori di disturbo diversi dalla predazione sui cuccioli di capriolo, forse
piuttosto legati alla particolare fisicità del cinghiale, in grado di spostare erbivori di minor taglia con la sua ingombrante ipertrofica presenza. A giudicare dai dati grezzi disponibili, tuttavia, una
maggiore pressione venatoria sul cinghiale potrebbe davvero modificare il grafico, consentendo al capriolo di recuperare l’evidente calo di densità. Una discreta (ma faticosa) indicazione di gestione venatoria del patrimonio venatorio carsolino.
Occorre peraltro sottolineare che l’interferenza fra capriolo e cinghiale potrebbe essere almeno in parte soltanto apparente, forse contemporaneamente condizionata da altri fattori, ancora poco noti. Fra di essi merita indicare la struttura della boscaglia carsica, sempre più matura e quindi meno adatta ad una specie di ecotono (margine forestale) qual è il capriolo. Altri eventuali possibili fattori biotici limitanti il capriolo potrebbero anche essere l’arrivo del cervo e la crescita demografica del camoscio, sul Carso notevole in certe zone.
Secondo Hubert Potočnik, che studia lo sciacallo in Slovenia per conto dell’Università di Lubiana, in una situazione di forte stress biologico legata all’invadenza del cinghiale forse anche la presenza dello sciacallo potrebbe divenire un fattore limitante per il capriolo, ma mancano dati per valutare questa possibilità. La corretta interpretazione dei pochi dati disponibili sia per l’Italia, sia per la Slovenia sembra essere dunque particolarmente complessa, richiedendo altre verifiche ed analisi su lunghi periodi e su aree ben più estese delle minuscole riserve del Carso italiano.
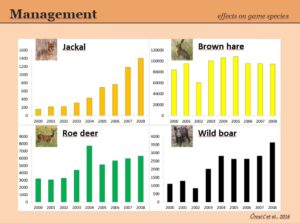
Secondo gli specialisti serbi che si sono a lungo occupati delle possibili interferenze fra sciacallo e specie oggetto di caccia, tuttavia, le statistiche venatorie indicherebbero che Canis aureus non
incida sulla selvaggina in maniera evidente (fig. 4, da Čirović et al., 2016).
Per saperne di più
Aukenthaler H., 2019. Totgebissener Goldschakal gefunden. Jaeger Zeitung (2: 2019): 28-29.
Bregoli M., Pesaro S., Beraldo P., Filacorda S., Fanin Y., Bille L., Lapini L., Benedetti P. & Binato G., 2018.
Descrizione di un episodio di avvelenamento di esemplari di sciacallo dorato (Canis aureus moreoticus). 36èmes Rencontres du GEEFSM 2018, Réserve d’Orlu, Dep. De l’Ariège, France, Recueil de Résumés: 9.
Čirović D., Penezić A. & Krofel M., 2016. Jackals as cleaners: Ecosystem services provided by a mesocarnivore in human-dominated landscapes. Biol. Conserv., 199: 51–55.
Lapini L., Dreon L., Caldana M. & Villa M., 2018. Distribuzione, espansione e problemi di conservazione di Canis aureus in Italia (Carnivora, Canidae). Quaderni del Museo Civico di Storia Naturale di Ferrara , 6 (2018) : 89-96.



1 commento su “Nuove Presenze, problemi vecchi: il caso dello sciacallo dorato (<em>Canis aureus</em>) in Italia.”
I commenti sono chiusi.